
三个月前,家用射频美容仪疯狂甩卖、清仓风暴让曾霸榜该类目销售榜首的觅光在业界被传出“经济困难”传言后,不得不发布声明辟谣。
家用射频美容仪从行业风口转瞬间变为烫手山芋,依据国家药监局曾公布的政策规定,2024年4月1日起,射频美容仪需按第三类医疗器械管理,可直到公告实施仍未有企业获证,意味着这类产品将短暂告别医美这个风口。
而在政策正式执行后的3个月,射频美容仪新规却迎来两年延期?
美容仪市场的“松绑期”
射频美容仪新规延期两年执行 H.D 时间拨回到2022年,在3月30日,国家食品药品监督管理局(下称“国家药监”)公布了《国家药监局关于调整《医疗器械分类目录》部分内容的公告(2022年第30号)》,将在2023年的4月1日正式把射频治疗仪、射频皮肤治疗仪类产品纳入第三类医疗器械目录管理,未依法取得医疗器械注册证不得生产、进口和销售。 但国内第三类医疗器械注册,从临床备案、试验完成、注册提交及至受理下证,整个注册流程需要花费近2年,投入资金也是近千万,这让相关企业面临着不小的挑战与压力,许多品牌也在此时选择退出射频美容仪品类。 可就在昨日,国家药监官网发布《关于进一步明确射频治疗仪类产品有关要求的公告(2024年第84号)》及相关解读。 国家药监局官方解读公告表示:“现阶段,手持式射频治疗仪、射频皮肤治疗仪的注册申请人多为家电企业,受疫情、有关标准实施等多重因素影响,产品检验、临床试验时间拉长,产品注册申报准备和资料补充还需一定的时间,故结合产品研发实际,统筹考虑公众用械安全和产业有序发展需要,发布相关公告。” 从4月1日关注射频美容仪第三类注册证相关信息到现在,仍无美容仪品牌获得三类医疗器械注册证。现下公开表示正在进行三类医疗器械证备案工作的美容仪品牌共有五家。分别是:雅萌、花至、觅光、OGP时光肌与玛丽仙。 在国家科学技术部政务服务平台有临床试验备案信息的共有雅萌、花至、觅光、OGP时光肌四个品牌,而玛丽仙则在2023年7月公开表示,已于2023年在广东省药品监督管理局完成临床试验备案,并成为首批开展多中心射频美容仪医疗器械临床试验的家用美容仪品牌。 各品牌的获证进度:稳步推进 某知名头部美容仪品牌人员坦言,“企业在今年面临不小的困难”,并用“半死不活”一词形容公司的处境。 此时国家药监局针对射频美容仪的“松绑”政策,给了各品牌喘息的时间。新规启用后,对射频仪品牌产品的研发、生产、销售都提出了更高的要求。 生产:门槛抬高,不但要产品注册认证,还要取得生产许可证、难度大。 销售:射频美容设备需按照第Ⅲ类医疗器械开展临床试验“持证上岗”,产品功效认证、临床试验周期比较长。 使用:2016年2月1日起施行的《医疗器械使用质量监督管理办法》对医疗器械的使用,从采购、贮存、维修等方面都有严格规定。 推广:电商平台对医疗器械企业入驻的门槛日趋严格,企业的入驻有着严格的相关监管法规制度和准入条件,审核流程也更严谨复杂,品牌在投放预算的分配也会多加考虑。 目前情况,各品牌只有两个选择:1.投入成本给现有产品做临床试验,取得医疗器械注册证;2.放弃射频美容仪这一类目的单品,转向做别的产品。 总体而言,新规已经给美容仪品牌开了第二扇窗,给予了2年喘息时间,接下来的时间,赛道的玩家们会选择重卖射频、取得牌照,还是转换赛道,从头开始布局产品?
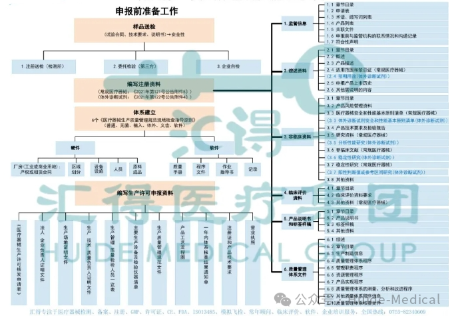
医疗器械注册证一键准入! 国家药监局为加强医疗美容机构药械质量安全,今后医器美械,医美料敷类,医美疗容机构各类认资证格和市场入准槛门将会进一步高提要求,早布局,早规范,欢有迎进入医疗域领的医仪美器,医美敷料类业企家朋友通过下方联系方式咨询。 汇得医疗集团有医射美频(射频美容仪),激光,超声,红蓝光,嫩肤,生发,皮肤,毛发,减脂,提拉,紧致,医软美件,皮肤理管等各医类美器械医和美敷料类凝胶,喷剂,膏体,液体,修贴复等各医类疗器注械册服案务例经验。 集团旗下拥有北京、广州、佛山、珠海、江西、湖南、湖北、广西、江苏、东莞、惠州、浙江、中山、四川、福建、河南及北美等分支机构,本着“立足湾区,服务中国、目标全球,打造智慧型、医疗产业链服务”的企业愿景,致力于肩负为客户提供全生命周期保驾护航使命。 来源|网络 国家药监局 汇得 编辑 | 闻道
