2025

01液体止鼾器的定义 液体止鼾器是一种医疗器械产品,主要用于治疗打鼾问题。它通常由喷瓶、喷嘴和止鼾液组成,通过外喷到咽喉部和上颚部位,软化咽喉部和鼻部内的黏膜,使黏膜受到药物湿润而收缩,降低上呼...
2025

01步态训练设备的概念 步态训练设备是指用于帮助患者改善步态、恢复步行能力的医疗设备。这些设备主要通过减轻下肢负担、提供正确的步态模式训练,帮助患者在康复过程中逐步恢复正常的行走能力。02步态训...
2025
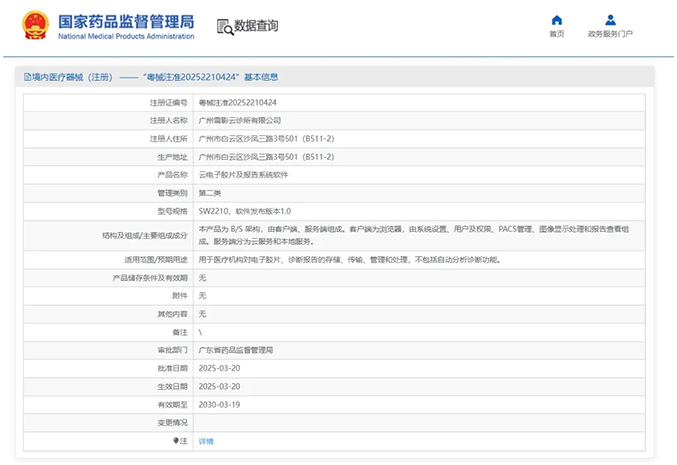
热烈祝贺,由我们汇得医疗CRO辅导合作的客户广州雪影云诊所有限公司自主研发的【云电子胶片及报告系统软件】产品成功获批广东省药品监督管理局第二类医疗器械产品注册证,意味着该产品可以在国内医疗市场开启合法...
2025

01导尿管的概念 导尿管是一种由尿道插入膀胱以便引流尿液的管道。是以天然橡胶、硅橡胶或聚氯乙烯(PVC)制成的管路,可以经由尿道插入膀胱以便引流尿液出来,导尿管插入膀胱后,靠近导尿管头端有一个气囊...
2025

热烈祝贺,由我们汇得医疗CRO辅导合作的客户广东斐尔医疗科技有限公司自主研发的【电切内窥镜】产品成功获批国家药品监督管理局第三类医疗器械产品注册证,意味着该产品可以在国内医疗市场开启合法生产与销售...
2025

01复用器械再处理系列——概述 2018-11-01国家药监局器审中心公开征求《可重复使用医疗器械再处理验证方法和标识注册技术审查指导原则(一)(征求意见稿)》意见;2019-10-18国家药监局...
2025
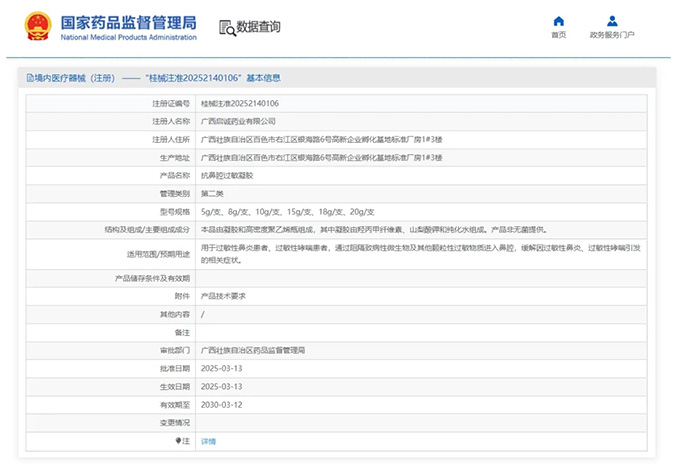
热烈祝贺,由我们汇得医疗CRO辅导合作的客户广西启诚药业有限公司自主研发的【抗鼻腔过敏凝胶】产品成功获批广西壮族自治区药品监督管理局第二类医疗器械产品注册证,意味着该产品可以在国内医美医疗市场开启合...
2025

要找到等同器械,可以遵循以下步骤,这些步骤基于FDA和行业经验,帮助制造商在寻找与他们的器械在技术、生物学和临床参数上相似的等同器械时做出明智的决策:01明确等同器械的定义标准技术特性相同:考虑器...
2025

为贯彻落实《国务院办公厅关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》(国办发〔2024〕53号),深入贯彻习近平总书记关于药品医疗器械监管和医药产业发展的重要指示批示精神,促进医...
2025

01准备申请材料 包括辐射安全许可证申请表、企业法人营业执照正、副本或事业单位法人证书正、副本及法定代表人身份证、环境影响评价批复文件或环境影响评价登记表、辐射管理专、兼职人员学历证明复印件、从事...
