2025
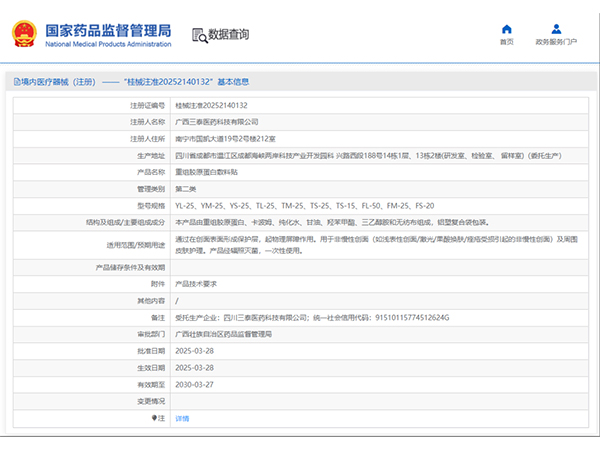
热烈祝贺,由我们汇得医疗CRO辅导合作的客户广西三泰医药科技有限公司自主研发的【重组胶原蛋白敷料贴】产品成功获批广西壮族自治区药品监督管理局第二类医疗器械产品注册证,意味着该产品可以在国内医美医疗市...
2025

美国FDA 510 (k) 所有权可以在持有人之间购买、出售或转让,而FDA不参与所有权的转让。01510 (k) 所有权持有者的定义: 当所有者或运营商作为510(k)设备的制造商manufac...
2025

自测用血糖试纸是否需要提交样本体积对监测系统的影响评估资料? 需要,应选择适当的评价方法研究样本体积对血糖检测的影响,并给出监测系统工作的允许样本体积范围。02血糖试纸(葡萄糖脱氢酶法)产品技术要...
2025

近年来,省医疗器械检验研究院深入贯彻落实“四个最严”要求,以强化质量管理体系为核心抓手,通过优化内部评审机制、强化监督队伍效能、推进多院区协同发展等举措,有效保障检验数据准确性和服务效能,持续完善检...
2025

为提高医疗器械生产企业质量体系管理人员对法规和标准的认识与理解,进一步强化管理者代表在质量管理体系中的职责,增强企业主体责任意识,提升质量管理水平,推进质量管理体系有效运行,广西医疗器械行业协会于4月...
2025

4月28日,国家药监局发布《医疗器械网络销售质量管理规范》,自2025年10月1日起施行。以下是全文:医疗器械网络销售质量管理规范第一章 总 则第一条 为加强医疗器械网络销售质量管理,规范医疗器械网络...
2025

为保障女性消费者的合法权益,同时满足大家对安全、优质化妆品的迫切需求,宁夏银川市市场监管局特此慎重提醒:化妆品≠医疗美容产品,要科学区分,规范使用!01什么是化妆品 现行的《化妆品监督管理条例》中...
2025

01飞检的特点特点一:行动的隐密性飞行检查安排即使在组织实施部门内也是相对隐密的,只有该项工作的主管领导和具体负责的同志掌握情况。企业所在地药品监督管理部门也是在最后时限才得到通知,企业更不可能得到通...
2025
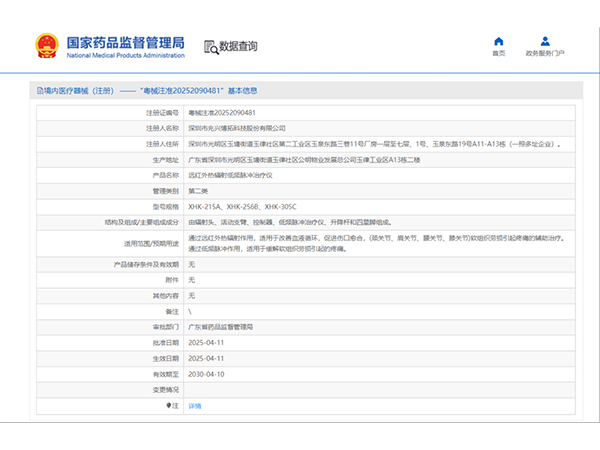
热烈祝贺,由我们汇得医疗CRO辅导合作的客户广东黄金海岸医药生物科技有限公司自主研发的【疤痕凝胶】产品成功获批广东省药品监督管理局第二类医疗器械产品注册证,意味着该产品可以在国内医美医疗市场开启合法生...
2025

医疗器械安规测试项目包括以下几项:1、结构检查与测试:测试设备的结构是否符合标准要求,包括各个部件的连接、固定、防护等。2、电源电压适应性:测试设备在规定范围内的电源电压下是否能正常工作。3、绝缘电阻...
