2025

01哪些医疗器械不需要进行临床试验?第一类医疗器械产品备案,不需要进行临床试验。申请第二类、第三类医疗器械产品注册,应当进行临床试验;但是,有下列情形之一的,可以免于进行临床试验: (一)工作机理明...
2025

为确保医疗器械的质量以及临床医疗使用的安全、有效,必须对其生产过程中涉及到的非活性材料进行生物相容性评价,以用于生产工艺过程的监控及最终产品的放行。因此,生物相容性评价是生物材料研究中始终贯穿的...
2025

生物相容性试验是生物医用材料与人体之间相互作用产生各种复杂的生物、物理、化学反应的一种概念,也是生物材料研究中始终贯穿的主题。一般来讲,生物相容性就是材料接触人体后与人体的相容程度,也就是说是否...
2025

01创新申报的优势1.优先核查:产品注册需要确定产品的分类,创新申报可以直接进行分类界定,优先进行注册检验、体系核查。2.缩短时间:国家局优先办理创新申请和优先创新技术审评,有专人负责对接,申报全过程...
2025

医疗器械临床评价是保障医械安全有效的关键环节,它贯穿于医疗器械从研发到上市后的整个生命周期。 通过科学严谨的临床评价,我们能够验证医疗器械的安全性和有效性,为产品的市场准入提供坚实依据,同时...
2025

芒种 芒种,是二十四节气之第九个节气,夏季的第三个节气,干支历午月的起始。斗指丙,太阳黄经达75°,于每年公历6月5-7日交节。“芒种”含义是“有芒之谷类作物可种,过此即失效”。这个时节气温显著升...
2025
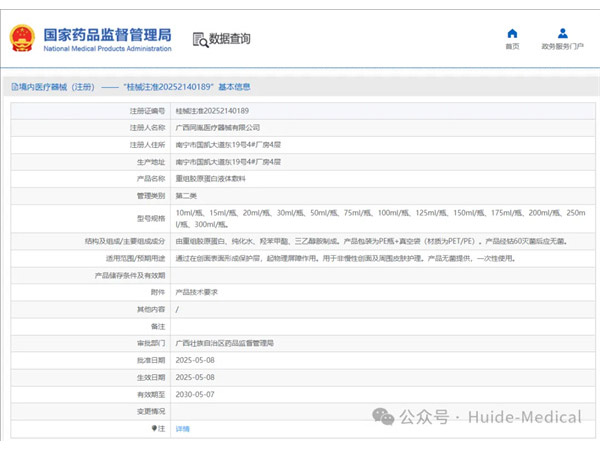
热烈祝贺,由我们汇得医疗CRO辅导合作的客户广西同胤医疗器械有限公司自主研发的【重组胶原蛋白液体敷料】产品成功获批广西壮族自治区药品监督管理局第二类医疗器械产品注册证,意味着该产品可以在国内医美医疗市...
2025

《医疗器械临床评价技术指导原则》(以下简称《指导原则》)明确了三种临床评价路径,即豁免目录内的临床试验豁免,同品种医疗器械临床使用数据和临床试验。因临床试验时间久,投资大,很多产品不在免临床目录...
2025

产品技术要求是医疗器械注册进程中最重要的文件之一,贯穿医疗器械检验、注册、体系考核、质量管理体系建设全程。 新的《医疗器械监督管理条例》、《医疗器械注册管理办法》、《医疗器械生产监督管理办法...
2025

近日,市场监管总局发布《医疗广告监管工作指南》(以下简称《指南》),进一步规范市场监管部门医疗广告监管工作。《指南》指出,在医疗广告中对功效、安全性作断言或者保证,或者说明治愈率、有效率的,依据...
