2025

01临床试验启动阶段1.1 获得药物临床试验批件 (国家CDE网站注册审批,有效期3年)1.2 制作研究者手册 理化性质、药理、药化、药效、毒理以及已有的临床研究资料,制作研究者手册。研究者手册是...
2025

01注册申报资料首次递交时未关联主文档,在补正资料阶段补充关联主文档是否可行? 根据《国家药监局关于医疗器械主文档登记事项的公告》(国家药品监督管理局2021年第36号)第二条“医疗器械注册申请人...
2025

体外诊断仪器作为医疗检测体系的核心设备,其性能稳定性直接关系临床诊断的可靠性。在日常使用中,仪器使用期限的设定基于严格验证数据,但面对实际运营需求,部分机构可能产生延长有效期的诉求。这种特殊需求...
2025

6月25日,江西医家人大湾区成员代表团赴广州,对央企标杆广东通用医药有限公司进行深度考察学习。此次活动旨在加强组织内部联谊,共享优质医药供应链资源,探索在医药、器械、生物制药及医疗机构等多领域的...
2025

原文链接:https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20250624112000177.html注:内容来源于国家药监【声明:向原作者...
2025
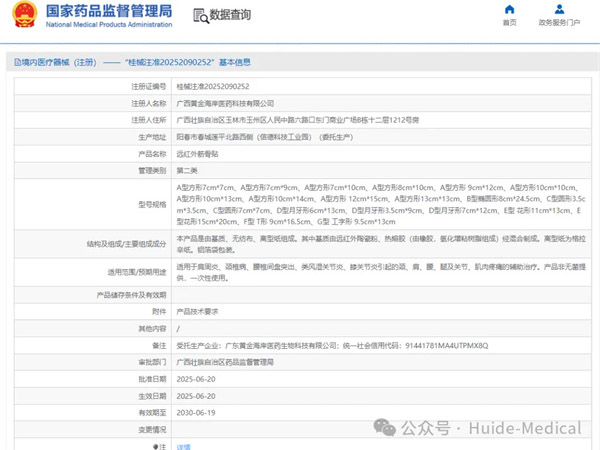
热烈祝贺,由我们汇得医疗CRO辅导合作的客户广西黄金海岸医药科技有限公司自主研发的【远红外筋骨贴】产品成功获批广西壮族自治区药品监督管理局第二类医疗器械产品注册证,意味着该产品可以在国内医美医疗市场开...
2025

01科学数据库中国期刊全文数据库:通常指中国知网(CNKI),是国内最大的数据库,收录了大量国内的医学期刊文献,包含众多医疗器械相关研究,能为国内医疗器械同品种文献检索提供丰富资料。美国《医学索引》(...
2025

按照《医疗器械注册与备案管理办法》、《体外诊断试剂注册与备案管理办法》的要求,申请注册或者进行备案提交的医疗器械产品检验报告可以是申请人、备案人的自检报告,也可以是委托有资质的医疗器械检验机构出...
2025

01同一种原材料是否允许有两个原材料供应商? 申报资料中需要对产品原材料供应商予以明确,如果同一种原材料有两家原材料供应商,申请人需对两家供应商所提供的原材料分别进行采购控制(涉及的申报资料包括原...
2025

01行政法规1医疗器械监督管理条例(国务院令第739)https://www.nmpa.gov.cn/xxgk/fgwj/flxzhfg/20250107162942191.html2《国务院关于修改...
