2025
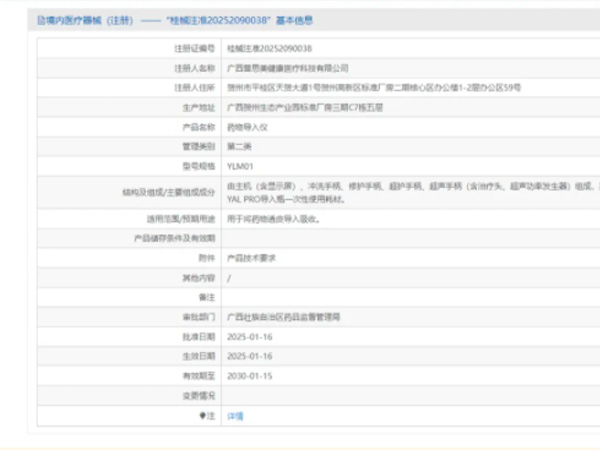
热烈祝贺,由我们汇得医疗CRO辅导合作的客户广西普思美健康医疗科技有限公司自主研发的【药物导入仪】产品成功获批广西壮族自治区药品监督管理局第二类医疗器械产品注册证,意味着该产品可以在国内医疗器械...
2025

医疗器械委托生产的相关法规,比如《医疗器械监督管理条例》和GMP要求,委托方和受托方的资质要求不同,如何确保双方都合规,可能需要审核对方的资质文件,签订质量协议等,国内医疗器械委托生产存在哪些管...
2025

北京市药监局发布有源产品相关问答,针对“北京器审咨询和预约系统”及北京药品及医疗器械创新服务站所收集的企业重点关注问题,进一步深度剖析:01有源设备老化试验需要对每一台产品做出厂检验吗?需要的话...
2025

热烈祝贺,由我们汇得医疗CRO辅导合作的客户福建悦宁生物科技有限公司自主研发的【聚乙二醇液体敷料】产品成功获批福建省药品监督管理局第二类医疗器械产品注册证,意味着该产品可以在国内医美医疗市场开启...
2025

在生活中有很多人深受口腔疾病的折磨,回避疼痛是所有人天生的特质,口腔治疗中的不舒适体验必然会导致患者产生焦虑和恐惧,从而否定口腔治疗。局部麻醉则可以抑制疼痛感觉的传递,使其不能传递到中枢神经系统...
2025

01机构与人员1.组织机构图2.各部门职责权限(体系文件中规定)3.任命书--生产负责人、质量负责人、管理者代表4.研发、生产、质量负责人法律法规培训记录、岗位说明书、考核记录5.专职检验员任命书或上...
2025

雨水●三候一候:水獭祭鱼 说的是雨水节气来临,水面冰块融化,水獭开始捕鱼了。水獭喜欢把鱼咬死后放到岸边依次排列,像是祭祀一般,所以有了“獭祭鱼”之说。二候:鸿雁来 雨水五日后,从北方飞往南方过...
2025

医疗器械的验证与确认是两个不同的概念,但在实际医疗器械检验和监管工作中发现,不单是生产企业,甚至监管人员都存在验证和确认概念不清的问题。由于概念不清,造成实施错误,甚至会带来产品在生产过程中出现...
2025

以下是关于医疗器械委托生产注册体系考核的详细说明,涵盖法规要求、考核流程、关键要点及注意事项,适用于医疗器械注册人(委托方)与受托生产企业(受托方)的合作模式:01法规依据1. 《医疗器械监督管...
2025

质量管理体系中的过程确认是确保特定过程能够持续产生符合要求结果的关键活动,尤其适用于那些无法通过后续检验完全验证的过程。以下是过程确认的详细解析:01定义与目的定义:过程确认是通过客观证据证实某...
