2025

热烈祝贺,由我们汇得医疗CRO辅导合作的客户广西同胤医疗器械有限公司自主研发的【医用重组胶原蛋白妇科凝胶】产品成功获批广西壮族自治区药品监督管理局第二类医疗器械产品注册证,意味着该产品可以在国内...
2025

01研发提问技巧技巧1:技术方案可行性验证"我现在需要设计具有抗凝血涂层的血管介入导管,已知涂层材料是肝素衍生物,导管基材为聚氨酯,请分析可能存在的涂层脱落风险,并提供3种改进方案的技术路线...
2025

开工大吉!耀启新程愿所有的客户、伙伴及朋友蛇年大发,财源广进,前程似锦! 各界同仁、朋友、同事们: 大家新年好!祥龙辞岁,金蛇送福,度过美好的新春佳节,我们迎来了2025年的开工之日。在此,我谨代...
2025

热烈祝贺,由我们汇得医疗CRO辅导合作的客户海南科妍药业有限公司自主研发的【重组胶原蛋白创面修护贴】产品成功获批海南省药品监督管理局第二类医疗器械产品注册证,意味着该产品可以在国内医美医疗市场开...
2025
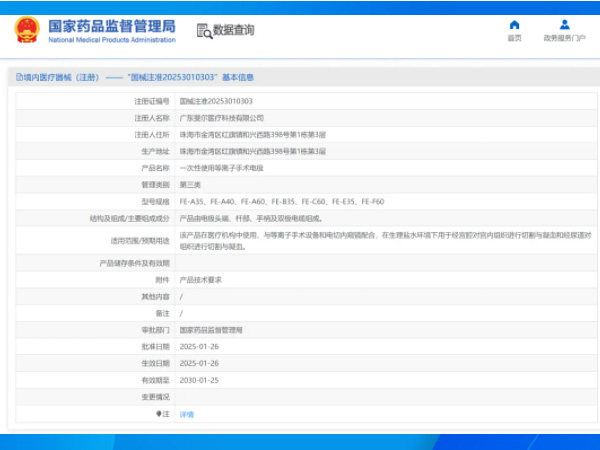
热烈祝贺,由我们汇得医疗CRO辅导合作的客户广东斐尔医疗科技有限公司自主研发的【一次性使用等离子手术电极】产品成功获批国家药品监督管理局第三类医疗器械产品注册证,意味着该产品可以在国内医疗器械市...
2025

初十 农历正月初十日,中国民间传统节日之一,称为石头节,为石头神生日,称“石磨日”、“十子日”、“石不动”等。这一天不准搬动石头和碾、磨、石臼等石器,俗信否则会伤了庄稼。这一天还忌开山打石和以石盖...
2025

为方便医疗器械行业同仁更快速寻找相关法规文件,小编将常用文件整理如下,可点击直接进入官网查看原文,欢迎收藏该推文。 该版本为2025年1月更新版本。 法规汇总目录如下:一、行政法规二、部...
2025

新的《医疗器械监督管理条例》、《医疗器械注册管理办法》、《医疗器械生产监督管理办法》等法规实施后,医疗器械产品技术要求取代了原来的产品注册标准。新法规实施之后,医疗器械产品技术作为一个新的重要的...
2025

初九 正月初九,又称大年初九,是中国传统农历节日之一。在民间有着“天公生”“玉皇会”“天诞节“上九日”等俗称。同时,这一天也是四川达州市元九登高节以及广西融安县苗族芒蒿节。在中国东南沿海尤其闽南,...
2025

初八 正月初八是中国农历正月的第一个逢八日,又被称为“谷日节”、“上灯节”或“敬八仙节”。在中国传统农耕文化中,这一天被视为谷子(五谷)的生日,是农业与五谷丰收的象征。正月初八在民间具有重要的地位...
