2025
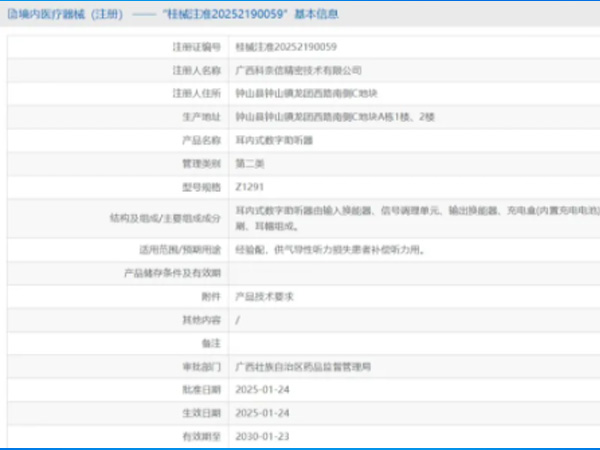
热烈祝贺,由我们汇得医疗CRO辅导合作的客户广西科奈信精密技术有限公司自主研发的【耳内式数字助听器】产品成功获批广西壮族自治区药品监督管理局第二类医疗器械产品注册证,意味着该产品可以在国内医疗器...
2025

01参加现场检查的人员 药监部门会提前发出现场检查方案。企业接到后,应按《医疗器械现场检查首次会议要点》通知所有人员检查当日不得出差,特殊情况(如病假或家庭紧急事件)需提前告知检查组和方案制定人并...
2025
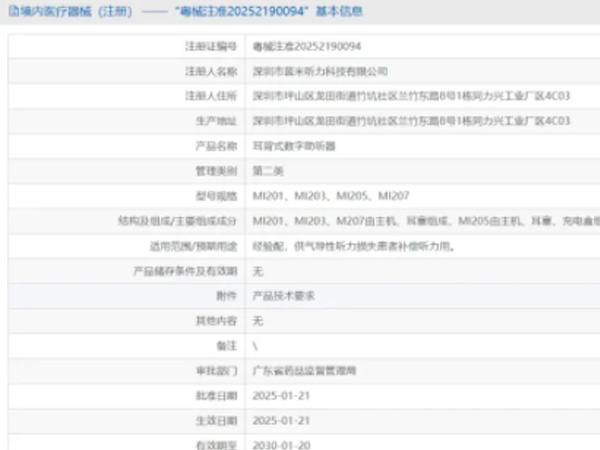
热烈祝贺,由我们汇得医疗CRO辅导合作的客户深圳市蓝米听力科技有限公司自主研发的【耳背式数字助听器】和【耳内式数字助听器】两个产品成功获批广东省药品监督管理局第二类医疗器械产品注册证,意味着该产...
2025
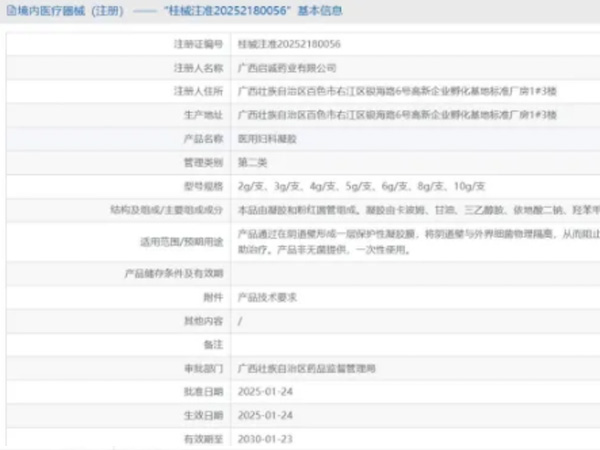
热烈祝贺,由我们汇得医疗CRO辅导合作的客户广西启诚药业有限公司自主研发的【医用妇科凝胶】产品成功获批广西壮族自治区药品监督管理局第二类医疗器械产品注册证,意味着该产品可以在国内医美医疗市场开启...
2025
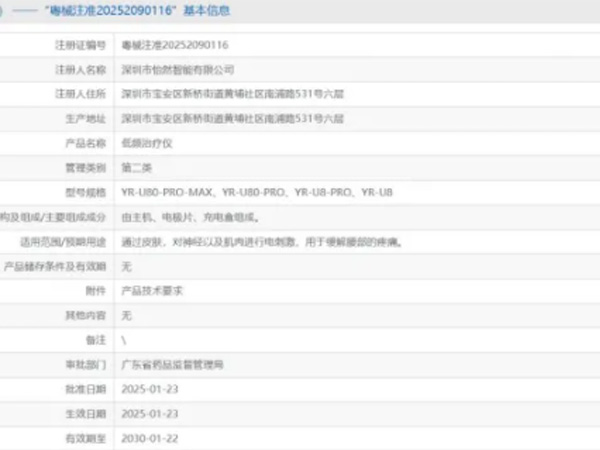
热烈祝贺,由我们汇得医疗CRO辅导合作的客户深圳市怡然智能有限公司自主研发的【低频治疗仪】产品成功获批广东省药品监督管理局第二类医疗器械产品注册证,意味着该产品可以在国内医疗器械市场开启合法生产...
2025

01某产品具有均属于《免于进行临床试验医疗器械目录》的多种适用范围,在产品注册时应如何提供临床评价资料? 可在保证与《目录》所述适用范围实质等同的前提下,对申报产品适用范围的文字表述做略微调整。其...
2025

元宵节,又称上元节、小正月、元夕或灯节,是中国的传统节日之一,时间为每年农历正月十五。正月是农历的元月,古人称“夜”为“宵”,正月十五是一年中第一个月圆之夜,所以称正月十五为“元宵节”。 正...
2025
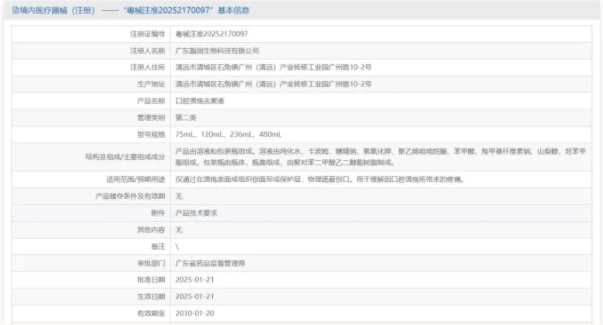
热烈祝贺,由我们汇得医疗CRO辅导合作的客户广东瀚润生物科技有限公司自主研发的【口腔溃疡含漱液】产品成功获批广东省药品监督管理局第二类医疗器械产品注册证,意味着该产品可以在国内医疗器械市场开启合...
2025

01总体概况 高端医械院数据中心统计,截至2024年12月,全国境内医疗器械经营企业达1527403家,较2023年底(1413740家)增长8.1%。2019年至2024年,全国境内医疗器械经营...
2025

01麻醉机和呼吸机用呼吸管路如何进行生物学评价? 产品首次注册时应根据产品所用材料及与人体的接触性质、接触时间,按照GB/T16886.1《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验...
