2025

为加强对我市第二类医疗器械(含体外诊断试剂)延续注册的指导服务,解决企业共性问题,提高延续注册审评效率,北京市医疗器械审评检查中心(以下简称中心)梳理了2025年第一季度延续注册审评发补关注点,...
2025

医疗器械注册质量管理体系核查是注册过程中的重要环节之一,其核心是通过对产品相关各项的核查,确认企业质量管理体系的建立与运行情况。01设计开发部分1. 申报的部分规格型号的产品无样品生产和检验记录...
2025

医疗器械关乎生命健康,重要性不言而喻,稍有差池便可能危害健康。在法规标准框架下,风险管理是不可逾越的底线。 我国《医疗器械监督管理条例》规定,产品风险分析资料是注册申报必备技术文件。风险管理...
2025

医美很多产品是非医疗器械,很多医疗器械产品当然也广泛在医美行业应用。因此,医美相关医疗器械注册问题问询非常多,非常频繁。一起来看一下官方答疑。01什么是热玛吉?热玛吉的作用原理是什么,能起到什么...
2025

医疗器械产品技术要求是指在医疗器械注册或备案过程中,由注册申请人提出并经监管机构认可的一系列技术指标,旨在确保医疗器械产品的功能性和安全性。 这些技术要求包括医疗器械产品的性能、结构、安全性...
2025

01二类医疗器械非血管腔道导丝无适用的标准,产品技术要求性能制定参考并引用了YY 0450.1-2003,检验方法规定了按照YY 0450.1-2003中的附录检验。我有两个问题需要您答复。 1.YY...
2025

医疗器械产品研发到批量生产流程,大致分为12个阶段,以下为研发、设计、生产阶段要点:01新产品立项 明确产品开发计划、市场调查、项目的经济意义、顾客需求、临床应用价值、公司人员匹配度等。02...
2025

01按照第一类医疗器械管理的“氧气吸入器(08-05-15)”进行产品备案时,申请人应如何编写产品描述? 申请人应按照《国家药监局关于第一类医疗器械备案有关事项的公告》(2022年第62号)及《国...
2025
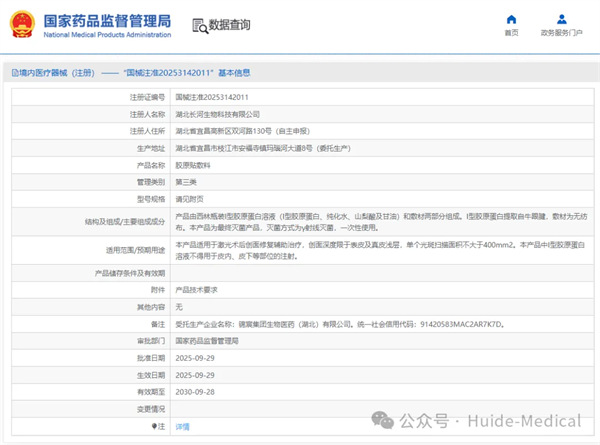
热烈祝贺,由我们汇得医疗CRO辅导合作的客户湖北长河生物科技有限公司自主研发的【胶原贴敷料】产品成功获批国家药品监督管理局第三类医疗器械产品注册证,意味着该产品可以在国内医疗市场开启合法生产与销售服务...
2025

01注册变更与说明书修改 当医疗器械产品的某些特性或性能发生变化,以至于需要进行注册变更时,申请人需按照《医疗器械注册管理办法》的规定,向监管部门提交变更申请。注册变更获得批准后,申请人应当立即根...
