2024
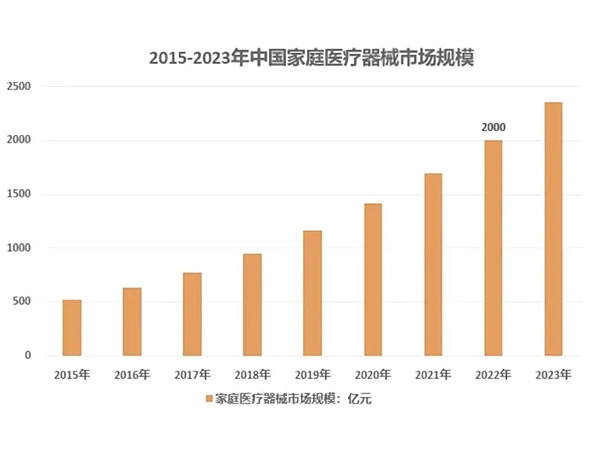
家用医疗器械,顾名思义,就是主要适于家庭使用的医疗器械,它区别于医院使用的医疗器械,操作简单、体积小巧、携带方便是其主要特征。早在很多年前,许多家庭就备有各种简单的医疗器械,如体温计、听诊器、血压计、...
2024
“数字疗法”(DigitalTherapeutics,缩写DTx)的权威的定义是 由软件程序驱动,以循证医学为基础的干预方案,用以治疗、管理或预防疾病。数字疗法可以单独使用,也可以与药物、医疗器械或其...
2024
可穿戴式医疗设备发展现状及思考背景:人口老龄化、支付能力提高、健康意识增强。国内外医疗健康市场需求持续增长,可穿戴医疗技术快速发展。可穿戴医疗设备定义:接触人体、监测记录生理参数,提供诊断、预防、治疗...
2024

通知近日,国家药品监督管理局医疗器械技术审批中心(Center For Medical Device Evaluation.NMPA)发布医疗器械优先审评申请审核结果公示,广州燃石医学检验所有限公司(...
2024

本篇为医械产品技术要求编写常见问题汇总整理—第俩百三十篇。第二类体外诊断试剂综述资料中预期用途适用人群如何描述?原则上产品临床性能应能支撑预期用途声称。应结合申报产品预期用途及临床适应证,明确目标患者...
2024

通知依据国家药品监督管理局《创新医疗器械特别审查程序》(国家药监局2018年第83号公告),创新医疗器械审查办公室组织有关专家对创新医疗器械特别审查申请进行审查,拟同意以下申请项目进入特别审查程序,现...
2024

本篇为医械产品技术要求编写常见问题汇总整理—第俩百二十九篇。产品正在进行新标的变更注册(合并型号及适用范围变更),已提交并受理,在这种情况下我能再提交一个变更注册吗?第二次变更是关于结构组成的型号变更...
2024

本篇为医械产品技术要求编写常见问题汇总整理—第俩百二十八篇。全降解封堵器拟扩大适用范围,对于新增适用范围是否需重新提交检验报告和开展动物试验?若原动物试验无法充分评价申报产品在新增适用范围下体内的初步...
2024

本篇为医械产品技术要求编写常见问题汇总整理—第俩百二十七篇。请问同品种临床评价对比器械可选择几种?可选择一种或多种对比器械,建议选取工作原理和作用机理尽可能相同的产品作为对比器械。请问同品种临床评价对...
2024

一通知为指导应用纳米材料的医疗器械产品的管理属性和管理类别判定,国家药监局组织起草了《应用纳米材料的医疗器械产品分类界定指导原则(征求意见稿)》,现向社会公开征求意见。请填写反馈意见表,并于2024年...
