2025

01我司一款无源无菌器械,首次注册效期2年,留样产品实时老化2年也通过测试,现想变更效期为3年; 问题: ①能否用实时老化2年的样品继续做1年的加速,证明产品能够实现3年效期? ②如果不能,建议的合规...
2025

料的医疗器械产品的管理属性和类别判定,国家药监局组织制定了《应用纳米材料的医疗器械产品分类界定指导原则》(以下简称指导原则)。为有效指导各方准确判定此类产品的管理属性和管理类别,并正确理解判定的相关要...
2025

为进一步规范含光源的近视控制、弱视治疗类医疗器械产品的管理属性和类别判定,国家药监局组织制定了《含光源的近视控制、弱视治疗类医疗器械产品分类界定指导原则》(以下简称指导原则)。为有效指导各方准确...
2025
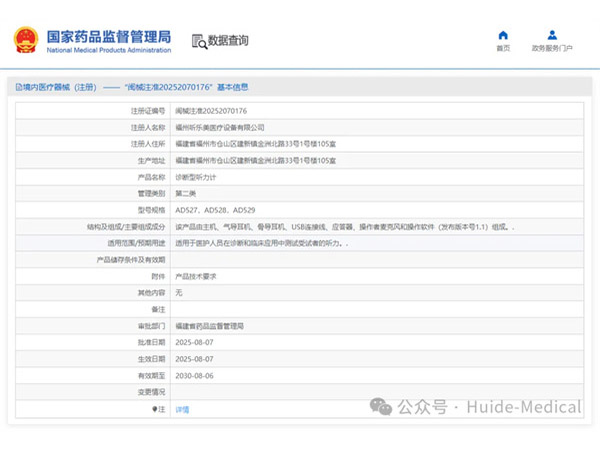
热烈祝贺,由我们汇得医疗CRO辅导合作的客户福州听乐美医疗设备有限公司自主研发的【诊断型听力计】产品成功获批福建省药品监督管理局第二类医疗器械产品注册证,意味着该产品可以在国内医疗市场开启合法生产与销...
2025
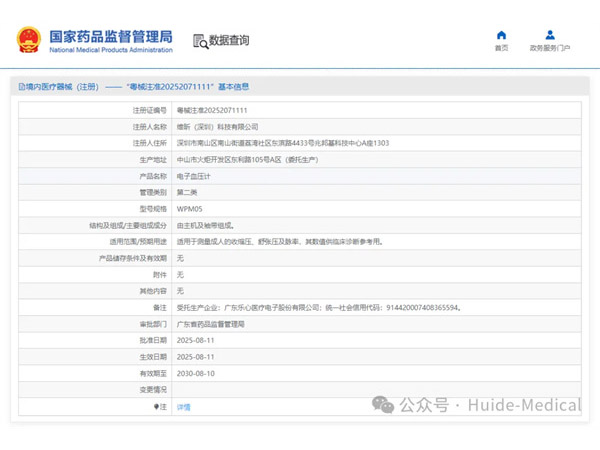
热烈祝贺,由我们汇得医疗CRO辅导合作的客户维昕(深圳)科技有限公司自主研发的【电子血压计】产品成功获批广东省药品监督管理局第二类医疗器械产品注册证,意味着该产品可以在国内医疗市场开启合法生产与销售服...
2025

01技术审评被退审的几率? 2022年10月1日实施的《医疗器械注册与备案管理办法》(总局令第47号)第五十四条:“技术审评过程中需要申请人补正资料的,技术审评机构应当一次告知需要补正的全部内容。...
2025

01瓣中瓣产品的临床评价中,适用范围中申报用于不同瓣位、入路方式、原有已毁损瓣膜类型需提供怎样的临床数据以证明安全有效性 不同瓣位(主动脉瓣、二尖瓣、三尖瓣)其解剖结构、压力类型、方向、流体力学等...
2025

01医疗器械不良事件监测 报告医疗器械不良事件应当遵循可疑即报的原则。医疗器械生产、经营企业、使用单位应当对所生产经营或者使用的医疗器械开展不良事件监测;发现医疗器械不良事件或者可疑不良事件,向所...
2025

医疗器械产品的注册申请被受理后,药监部门是要对企业开展质量管理体系核查的,具体可通过资料审查或者现场检查的方式开展质量管理体系核查。 根据国家药监局2022年发布的《医疗器械注册质量管理体系...
2025

01设计开发部分1.申报的部分规格型号的产品无样品生产和检验记录;2.未能提供申报注册的所有规格型号产品的电磁兼容报告;3.提供虚假的样品生产记录(注意:提供虚假记录可终止现场检查);4.未提供产品内...
